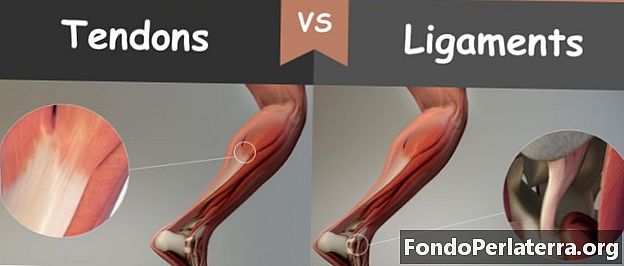
Атомна маса проти атомного числа

Зміст
- Зміст: Різниця між атомною масою та атомним числом
- Що таке атомна маса?
- Що таке атомне число?
- Ключові відмінності
Атомна маса та атомні числа - це два терміни, які широко використовуються в поняттях хімії та фізики. Для розуміння ключових понять науки обидва ці терміни мають важливе значення. У більшості випадків ці два терміни плутають людей, вони замінюють обидва ці терміни. Однак вони дуже відрізняються один від одного, хоча обидва ці терміни мають певну схожість, але вони відрізняються один від одного. Властивості та характеристики різних матеріалів, речовин і елементів неможливо зрозуміти, розуміючи значення цих термінів. Атомне число використовується для того, щоб чітко визначити, яким елементом є матеріал чи, можливо, речовина. Він визначається і описується як кількість протонів, що містяться в ядрі елемента елемента, тоді як, з іншого боку, атомна маса, безумовно, є числом, пов'язаним як з протонами, так і з нейтронами, що містяться в конкретному ядрі, пов'язаному з елементом. Електрони дійсно не важать значно, тому атомна маса фактично визначається при додаванні до нейтронів кількості, пов'язаної з протонами. Крім того, він відомий як атомна маса.

Зміст: Різниця між атомною масою та атомним числом
- Що таке атомна маса?
- Що таке атомне число?
- Ключові відмінності
- Відео Пояснення
Що таке атомна маса?
Масове число або відоме як атомне масове число позначається (A), як правило, написане у верхній частині елемента, воно також називається атомним масовим числом або, можливо, нуклоновим числом, безумовно, є кінцевою кількістю, що включає протони та нейтрони (які разом називаються нуклонами) в межах атомного ядра. Він визначає конкретну атомну масу атомів. Зважаючи на те, що протони, а також нейтрони, обидва вони є баріонами, особливе масове число А схоже разом із числом баріона В, оскільки воно є конкретним ядром усього атома чи навіть іона. Масове число абсолютно різне для кожного окремого ізотопу компонента хімічної речовини. Це просто не те саме, що атомний номер (Z). Масове число подається іноді за назвою елемента або, можливо, як надпис зліва від символу вашого елемента. Наприклад, найбільш типовим ізотопом, що включає вуглець, є, безумовно, вуглець-12, або 12С, який включає 6 протонів, а також 6 нейтронів. Повний ізотопний знак, безперечно, також мав би атомний номер. Масове число не слід плутати з іншим подібним терміном, який відносна атомну масу елемента.
Що таке атомне число?
Атомне число позначається «Z». Що стосується хімії, а також фізики, зазвичай число атомів, пов'язане з хімічним елементом (також зване числом протона), безумовно, є число протонів, ідеально розташованих у ядрі, пов'язаних з атомом цього елемента, і саме тому аналогічно номеру заряду конкретного ядра. Це дійсно традиційно символізується зображенням Z. Атомне число визначає виключно хімічний елемент. У межах незарядженого атома конкретне атомне число також можна порівняти з кількістю електронів. Атомне число, Z, потрібно припинити неправильно ідентифікувати як масове число, A, яке є числом нуклонів, Кількість нейтронів, N, розпізнається як число нейтронів, пов'язане з атомом; отже, A = Z + N (всі ці суми завжди будуть цілими числами). Оскільки протони, а також нейтрони мають приблизно однакову масу (так само як маса електронів, безумовно, незначна для багатьох цілей), а також проблема маси, пов'язана з зв'язуванням нуклонів, зазвичай менша порівняно з конкретною масою нуклонів, атомною масою атом, коли це вказано всередині одиниць атомних одиниць маси Атоми з точно таким же атомним числом Z, однак чітке число нейтронів N, і, отже, атомні маси, класифікуються як ізотопи.
Ключові відмінності
- Атомне число представлено «Z», тоді як атомна маса представлена «A».
- Атомна маса не визначає тип елемента, тоді як атомне число визначає тип елемента.
- Атомна маса використовується для показу різних ізотопів одного і того ж елемента, тоді як для атомного числа це не стосується.
- Атомна маса вимірюється в одиниці атомної маси (amu), тоді як атомне число - це лише число.
- Кількість електронів завжди дорівнює атомному числу, але не дорівнює масовому числу.
- Якщо атомне число велике, це означає, що атомна маса також буде високою.