Кулясті білки проти волокнистих білків
Зміст
- Зміст: Різниця між кулеподібними білками і волокнистими білками
- Основна різниця
- Порівняльна діаграма
- Кульковий білок
- Фіброзний білок
- Ключові відмінності
Зміст: Різниця між кулеподібними білками і волокнистими білками
- Основна різниця
- Порівняльна діаграма
- Кульковий білок
- Фіброзний білок
- Ключові відмінності
Основна різниця
Тип білків, які найчастіше зустрічаються навколо, мають сферичну природу і легко розчиняються у воді, на відміну від інших типів, відомих як кульові білки. Тип білків, що зустрічаються лише у тварин і має форму стрижня, схожий на дріт, поранений навколо структури, стає таким, як волокнисті білки.
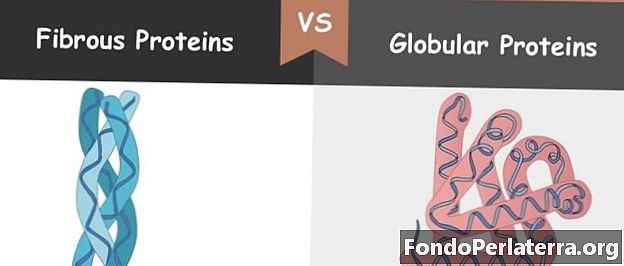
Порівняльна діаграма
| Основа | Кульковий білок | Фіброзний білок |
| Визначення | Тип білків, які найчастіше зустрічаються навколо, мають сферичну природу і легко розчиняються у воді, на відміну від інших типів. | Тип білків, що зустрічаються лише у тварин, має форму стрижня, яка може бути схожою на дріт, поранену навколо споруди. |
| Відмінність | Інша назва, яка використовується для таких видів білків, включає сферопротеїни, оскільки вони мають сферичну форму і найбільш поширені разом з волокнистими, мембранними та невпорядкованими білками. | Інша назва, що використовується для таких типів, включає склеропротеїни і в основному застосовується як накопичувальний білок, який стає корисним, коли існує нестача такого живлення в організмі. |
| Природа | Нерозчинний у воді. | Розчинний у воді, кислотах та основах. |
| Приклад | Шовк, шерсть, шкіра. | Яйце, молоко та ін. |
Кульковий білок
Тип білків, які найчастіше зустрічаються навколо, мають сферичну природу і легко розчиняються у воді, на відміну від інших типів стають відомими як кульові білки. Інша назва, яка використовується для таких видів білків, включає сферопротеїни, оскільки вони мають сферичну форму і найбільш поширені разом з волокнистими, мембранними та невпорядкованими білками. Як і у всіх білків, основна структура кульових білків включає поліпептид або ланцюг амінокислот, з'єднаних за допомогою пептидних зв'язків. Водневі зв’язки серед карбоксильних та амінових скупчень амінокислот додають допоміжній структурі, яка в кульових білках може включати альфа-спіралі, бета-листи або обидва.
Клобулярні білки розпадаються настільки, що їх третинна структура складається з полярних або гідрофільних амінокислот, оркестрованих зовні і неполярних, або гідрофобних, амінокислот у тривимірній формі. Цей ігровий план контролює платоспроможність кульових білків у воді. Кульові білки просто можливо стабільні, оскільки вільна життєва сила, що виділяється при руйнуванні білка на місцеву придатність, мало. Це тому, що руйнування білка вимагає ентропічних витрат. Оскільки важлива послідовність поліпептидного ланцюга може формувати різні адаптації, місцева глобулярна структура обмежує його відповідність на пару, як це було. Деяка частина проблеми, що руйнується білками, полягає в тому, що мало нековалентних слабких сполук обрамлено, наприклад, водневі зв’язки та асоціації Ван дер Ваальса. Використовуючи декілька систем, компонент розпаду білка наразі розглядається. Дійсно, навіть у денатурованому стані білка він може бути розбитий до потрібної структури.
Фіброзний білок
Тип білків, що зустрічаються лише у тварин і має форму стрижня, схожий на дріт, поранений навколо структури, називають волокнистими білками. Інша назва, що використовується для таких типів, включає склеропротеїни і в основному застосовується як накопичувальний білок, який стає корисним, коли існує нестача такого живлення в організмі. Строгі білки, які ще називають склеропротеїнами, - це довгі нитчасті атоми білка. Строгі білки обрамляють «полюсові» або «дротяні» форми і є прихованими допоміжними білками або ємностями. Вони нерозчинні у воді. Білі жилки звичайно використовуються для побудови сполучних тканин, зв’язок, кісткової та м’язової клітковини.
Фіброзний білок - це білок з розтягнутою формою. Строгі білки надають допоміжну підтримку клітинам і тканинам. Існують надзвичайні сорти спіралей, присутніх у двох волокнистих білках α-кератину та колагену. Ці білки обрамляють довгі нитки, які служать фундаментальній частині людського організму. Живчасті білки розпізнаються кулеподібними білками по нитчастому, подовженому кадру. Крім того, строгі білки мають низьку розчинність у контрастній воді та високу платоспроможність у воді кульових білків.
Значна частина їх займає найважливіші частини в істотах клітини та тканини, утримуючи речі разом. Білки Sinewy мають амінокорозійні сукцесії, які підтримують певний різновид факультативної структури, яка, як це, має специфічні механічні властивості білків. Людське волосся дає гідний випадок того, як жировики мають первинну здатність. Принциповий білок у волоссі називається альфа-кератином. Хоча поки невідомо, як білки в основному згортаються, нове підтвердження викликає розуміння.
Ключові відмінності
- Тип білків, які найчастіше зустрічаються навколо, мають сферичну природу і легко розчиняються у воді, на відміну від інших типів стають відомими як кульові білки. Клас білків, які містяться лише у тварин, мають форму стрижня, яка може виглядати як дріт, поранена навколо структури, називається волокнистими білками.
- Інша назва, яка використовується для таких видів білків, включає сферопротеїни, оскільки вони мають сферичну форму і найбільш поширені разом з волокнистими, мембранними та невпорядкованими білками.
- Інша назва, що використовується для таких типів, включає склеропротеїни і в основному використовується як накопичувальний білок, який стає корисним, коли існує нестача такого живлення в організмі.
- Фіброзні білки не мають властивості розчинятися у воді і тому залишаються нерозчинними. З іншого боку, кульові білки нерозчинні у воді та навіть кислотах та основах.
- Сила тяжіння, яка існує між молекулами для волокнистих білків, залишається набагато сильнішою. З іншого боку, сила тяжіння, яка існує між кулеподібними білками, має слабке водневе зв’язок.
- Основний тип волокнистих білків включає шовк, шерсть та шкіру. З іншого боку, до основних видів кульових білків належать яйце, молоко та ін.